Calidad 4.0: estrategias para el desarrollo de terapias avanzadas

La biotecnología ha entrado en una fase de aceleración: medicamentos biológicos, ingeniería tisular, terapias génicas, productos celulares y medicinas personalizadas salen del laboratorio hacia ensayos clínicos y mercados en tiempos cada vez más cortos. Este dinamismo tecnológico y regulatorio impone a las organizaciones una doble exigencia: garantizar la seguridad y eficacia de los productos sin frenar el ritmo de la innovación.
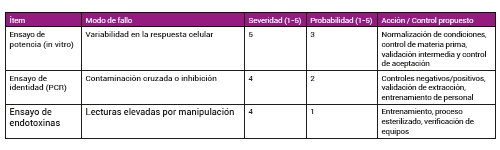
Los sistemas de calidad dejan de ser un mero requisito administrativo y se convierten en una palanca estratégica fundamental a la confianza regulatoria y la escalabilidad manufacturera. Konexio Biotech, con su experiencia en diseño e implementación de sistemas de calidad, auditorías y roadmaps regulatorios, acompaña a proyectos biotecnológicos en la transición desde la investigación hasta la fase clínica, integrando principios de calidad por diseño y gestión del riesgo (Tabla 1).
En el caso del desarrollo de un vector viral para terapia génica, la estrategia analítica típicamente combina ensayos de identidad (PCR, secuenciación), pureza (ensayos de impurezas virales), potencia funcional (ensayos de transducción o expresión) y seguridad (ensayos de replicación, endotoxinas). La validación de estas técnicas requiere planes de validación escalonados: (i) pruebas de metodología en fase preclínica, (ii) estudios de robustez y rango durante la transferencia tecnológica, y (iii) validación completa para lotes de liberación clínica, ajustada a la naturaleza biológica del producto. La incorporación de PAT —por ejemplo, espectroscopía Raman para monitorización de cultivos celulares o biosensores en línea para parámetros de proceso— reduce la variabilidad y mejora la detectabilidad temprana de desviaciones, acelerando decisiones de liberación bajo control.
A pesar de las herramientas disponibles, persisten conflictos y puntos críticos: la naturaleza heterogénea de materias primas biológicas dificulta la comparación entre lotes; las metodologías de potencia a menudo no son únicas ni fácilmente cuantificables; la gestión de la cadena de suministro para materiales sensibles (células, virus, medios) exige controles logísticos y de calidad específicos; y la gobernanza de datos (integridad y trazabilidad) es cada vez más objeto de inspección. Registros incompletos, sistemas informáticos no validados o malas prácticas en laboratorio continúan siendo causantes de observaciones regulatorias. En el caso de ATMPs, la regulación europea incluye guías específicas y flexibilidades técnicas, pero a su vez exige mayor justificación científica y trazabilidad para decisiones sobre exenciones o simplificaciones en estudios preclínicos y de liberación.
En síntesis, la gestión de calidad exige un equilibrio entre rigurosidad regulatoria y adaptabilidad técnica. Las recomendaciones prácticas que surgen de la experiencia de Konexio Biotech y de las guías internacionales son: (1) implementar un PQS escalable alineado con ICH Q10; (2) aplicar QRM (ICH Q9) desde el diseño experimental hasta la liberación para priorizar recursos; (3) invertir en estrategias analíticas robustas y en PAT para reducir la incertidumbre en la fabricación; (4) fortalecer la gobernanza de datos con políticas de integridad y validación de sistemas; y (5) documentar y validar la cadena de suministro para materiales críticos. Estas acciones no solo satisfacen a los reguladores, sino que reducen el riesgo, acortan tiempos y disminuyen costes.
Bibliografía
- European Medicines Agency. (2001). Guideline on quality, non-clinical and clinical aspects of gene therapy medicinal products. EMA. https://www.ema.europa.eu/en/documents/scientific-guideline/guideline-quality-non-cl inical-and-clinical-aspects-gene-therapy-medicinal-products_en.pdf
- European Medicines Agency. (2017). EudraLex - Volume 4: EU Guidelines for Good Manufacturing Practice for Medicinal Products for Human and Veterinary Use. European Commission. https://health.ec.europa.eu/medicinal-products/eudralex/eudralex-volume-4_en
- Food and Drug Administration. (2018). Data integrity and compliance with drug CGMP: Questions and answers. FDA. https://www.fda.gov/regulatory-information/search-fda-guidance-documents/data-inte grity-and-compliance-drug-cgmp-questions-and-answers
- International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use (ICH). (2005). ICH Q2(R1): Validation of analytical procedures: Text and methodology. https://database.ich.org/sites/default/files/Q2%28R1%29%20Guideline.pdf
- International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use (ICH). (2008). ICH Q10: Pharmaceutical quality system. https://database.ich.org/sites/default/files/Q10%20Guideline.pdf
- International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use (ICH). (2021). ICH Q9(R1): Quality risk management. https://database.ich.org/sites/default/files/ICH_Q9-R1_Document_Step2_Guideline_20 21_1118.pdf
- Pharmaceutical Inspection Co-operation Scheme (PIC/S). (2021). Guide to good manufacturing practice for medicinal products. https://picscheme.org/docview/6606
- Salmikangas, P., Pignatti, F., & Tsiftsoglou, A. (2023). Potency testing of cell and gene therapy products. Molecular Therapy – Methods & Clinical Development, 30, 79–88. https://pubmed.ncbi.nlm.nih.gov/37215709/
- Singh, R., Kim, Y., & Lee, S. (2021). Process analytical technology (PAT): Review and applications in biopharmaceutical manufacturing. Biotechnology Advances, 49, 107733. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8234957/
- Tiberio, L., Marchesi, S., & Cossu, G. (2025). Overviews and challenges in ATMP manufacturing: Current status and future directions. Frontiers in Bioengineering and Biotechnology, 13, 12274769. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC12274769/
| Nombre | Gonzalo Gispert Fernández, Fabiana Isabel Lara Bendeck y Javier Raboso Gallego |
|---|---|
| Empresa | Konexio Biotech |
| Cargo | Ex Técnico de Garantía de Calidad, prácticas de Regulatory Affairs, y responsable de I+D+i y Preclínica Regulatoria, respectivamenteia, Konexio Biotech. |
Si continúas navegando, aceptas su uso.
Más información
Política de privacidad | Cookies | Aviso legal | Información adicional| miembros de CEDRO