Desarrollo de un sustituto de la membrana timpánica mediante el uso de materiales naturales como tratamiento de las perforaciones crónicas

Más que ninguna otra metodología, la microscopía electrónica ha contribuido a nuestro conocimiento de la organización de las células y de la estructura de los virus. La microscopía electrónica sigue jugando un papel clave en el descubrimiento de nuevos organismos, sobre todo virus y es de gran ayuda para estudiar las etapas de su ciclo vital. Cualquiera de esas etapas es susceptible de ser bloqueada por un fármaco antiviral. Y para validar y comprender el mecanismo de acción de los antivirales, la microscopía electrónica está jugando un importante papel.
Las perforaciones de la membrana timpánica (PMT) afectan a un 2,1 % de la población mundial, siendo causadas principalmente por traumatismos e infecciones del canal auditivo [1]. La magnitud de las perforaciones, que se clasifican según su tamaño y ubicación, se relaciona directamente con la sintomatología. Todas las PMT están generalmente asociadas a pérdida de plenitud auditiva e hipoacusia [2,3]. La mayoría de las perforaciones (80-90 %) cierran espontáneamente en las primeras 4 semanas. La ubicación y tamaño de la perforación, así como la capacidad regenerativa del propio paciente, son los factores que más afectan a dicha regeneración espontánea [4–6]. La capacidad regenerativa inherente de la MT se atribuye a la presencia de células progenitoras latentes, que comparten similitudes con otras células madre epiteliales. El cierre espontáneo de la PMT está guiado por el epitelio timpánico, que cierra la perforación mediante hiperproliferación. Inicialmente, el epitelio queda suspendido en el aire, y posteriormente las capas fibrosa y mucosa que completan la estructura histológica del tímpano rellenan el defecto, cerrando por completo el daño [7,8].
Desarrollo de una nueva solución basada en la ingeniería tisular
Para el diseño del SMT se optó por una formulación basada en gelatina, al ser un biomaterial ampliamente utilizado en otología que favorece las interacciones célula-matriz y la actividad celular [11]. La gelatina se formuló con agar, que confiere soporte estructural [12]; glicerol, un plastificante que otorga flexibilidad al constructo [13]; y lactosa, que reticula químicamente con la gelatina [14]. Dicha formulación fue recientemente registrada en la Oficina Europea de Patentes (n.º 24382019.8). El film resultante demostró propiedades combinadas de hidratación y semipermeabilidad que favorecen la proliferación, migración y el correcto funcionamiento tanto de las células epidérmicas como de los fibroblastos, garantizando así un microentorno propicio para la regeneración timpánica efectiva [15].
El SMT presenta superficie rugosa, lo que fomenta la interacción célula-biomaterial. El anclaje mecánico al soporte favorece el crecimiento y proliferación celular. Asimismo, la rugosidad superficial es ventajosa para promover la adhesión al tejido circundante durante la colocación quirúrgica, por lo que postulamos que la técnica de implantación mejorará la accesibilidad para los clínicos y minimizará las molestias para los pacientes. El biomaterial es transparente, lo que es de especial interés en el contexto otológico ya que posibilita la observación de estructuras internas del oído [16]. Además, el biomaterial muestra cualidades adecuadas para soportar las presiones diferenciales dentro del conducto auditivo externo. El grosor del film oscila entre 70 y 140 µm, en función del grado de hidratación, asemejándose al grosor del tímpano humano. Se ha descrito que la adecuación del grosor afecta no solo a la integración del constructo, sino a los patrones de vibración y a la eficacia de transmisión del sonido [17,18].
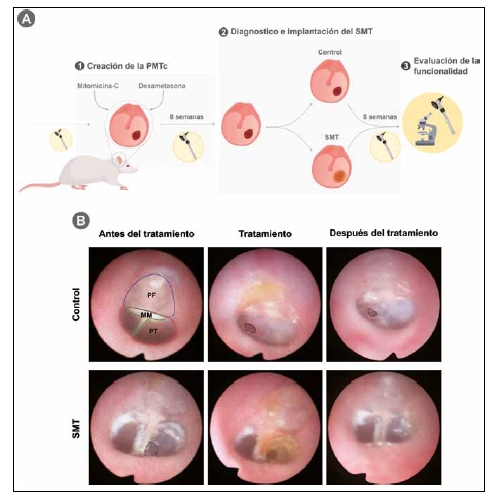
Evaluación de la funcionalidad e integración del SMT en un modelo de PMTc. A) Etapas y flujo de trabajo del ensayo in vivo. B) Evaluación otoscópica de la implantación in vivo del SMT. En la imagen superior izquierda se muestra una MT sana donde se distinguen las principales estructuras que componen el tímpano (PF: pars fláccida, PT: pars tensa, MM: mango del martillo). En el resto de imágenes se presenta el seguimiento realizado a las perforaciones de control (sin tratamiento) y las tratadas con el SMT, antes de la perforación, el día de tratamiento y a tiempo final tras 2 meses desde la colocación del injerto.
Potencial del SMT como tratamiento de las PMTc
Como conclusión, estos resultados preliminares destacan el potencial del sustituto desarrollado para el tratamiento de las PMTc, despuntando como un dispositivo de implantación simple, seguro, rentable, manejable y potencialmente efectivo. El SMT es uno de los dos productos que la Unidad de Terapias Avanzadas del IIS BioGipuzkoa-Hospital Universitario Donostia tiene previsto llevar a fases clínicas en los próximos años en el ámbito del Consorcio Estatal en Red para el desarrollo de Medicamentos de Terapias Avanzadas (CERTERA), gracias a la financiación obtenida específicamente para ello por parte del Instituto de Salud Carlos III (ISCIII). El Consorcio CERTERA es una infraestructura científico-técnica de I+D+I en red orientada al desarrollo de medicamentos de terapia avanzada desde los entornos académicos hasta los ensayos clínicos en fases precoces (pre-comerciales).
Agradecimientos
- [1] A.S. Kim, J.F. Betz, N.S. Reed, B.K. Ward, C.L. Nieman, Prevalence of Tympanic Membrane Perforations Among Adolescents, Adults, and Older Adults in the United States, Otolaryngol.--Head Neck Surg. 167 (2022) 356–358. https://doi.org/10.1177/01945998211062153.
- [2] N. Dolhi, A.D. Weimer, Tympanic Membrane Perforations, in: StatPearls, StatPearls Publishing, Treasure Island (FL), 2023. http://www.ncbi.nlm.nih.gov/books/NBK557887/ (accessed June 1, 2023).
- [3] F.H. A. T., R. Prasad K. U., A clinical study of traumatic tympanic membrane perforation, Int J Otorhinolaryngol Head Neck Surg 7 (2021) 1668. https://doi.org/10.18203/issn.2454-5929.ijohns20213903.
- [4] L. Castelhano, F. Correia, T. Colaço, L. Reis, P. Escada, Tympanic membrane perforations: the importance of etiology, size and location, Eur Arch Otorhinolaryngol 279 (2022) 4325–4333. https://doi.org/10.1007/s00405-021-07186-6.
- [5] M.E. Jellinge, S. Kristensen, K. Larsen, Spontaneous closure of traumatic tympanic membrane perforations: observational study, J. Laryngol. Otol. 129 (2015) 950–954. https://doi.org/10.1017/S0022215115002303.
- [6] Z.-C. Lou, Y.-M. Tang, J. Yang, A prospective study evaluating spontaneous healing of aetiology, size and type-different groups of traumatic tympanic membrane perforation: Factors affecting spontaneous healing of traumatic tympanic membrane perforation, Clinical Otolaryngology 36 (2011) 450–460. https://doi.org/10.1111/j.1749-4486.2011.02387.x.
- [7] P.L. Santa Maria, S.L. Redmond, M.D. Atlas, R. Ghassemifar, Histology of the healing tympanic membrane following perforation in rats: Tympanic Membrane Healing Histology, The Laryngoscope 120 (2010) 2061–2070. https://doi.org/10.1002/lary.20998.
- [8] S.W. Kim, J. Kim, H. Seonwoo, K.-J. Jang, Y.J. Kim, H.J. Lim, K.-T. Lim, C. Tian, J.H. Chung, Y.-H. Choung, Latent progenitor cells as potential regulators for tympanic membrane regeneration, Sci Rep 5 (2015) 11542. https://doi.org/10.1038/srep11542.
- [9] M. Nardone, R. Sommerville, J. Bowman, G. Danesi, Myringoplasty in Simple Chronic Otitis Media: Critical Analysis of Long-Term Results in a 1,000-Adult Patient Series, Otology & Neurotology 33 (2012) 48–53. https://doi.org/10.1097/MAO.0b013e31823dbc26.
- [10] B.C.A. Van Stekelenburg, M.C.J. Aarts, Determinants influencing success rates of myringoplasty in daily practice: a retrospective analysis, Eur Arch Otorhinolaryngol 276 (2019) 3081–3087. https://doi.org/10.1007/s00405-019-05611-5.
- [11] M.C. Echave, L.S. Burgo, J.L. Pedraz, G. Orive, Gelatin as Biomaterial for Tissue Engineering, CPD 23 (2017). https://doi.org/10.2174/0929867324666170511123101.
- [12] M.A. Salati, J. Khazai, A.M. Tahmuri, A. Samadi, A. Taghizadeh, M. Taghizadeh, P. Zarrintaj, J.D. Ramsey, S. Habibzadeh, F. Seidi, M.R. Saeb, M. Mozafari, Agarose-Based Biomaterials: Opportunities and Challenges in Cartilage Tissue Engineering, Polymers 12 (2020) 1150. https://doi.org/10.3390/polym12051150.
- [13] M.G.A. Vieira, M.A. Da Silva, L.O. Dos Santos, M.M. Beppu, Natural-based plasticizers and biopolymer films: A review, European Polymer Journal 47 (2011) 254–263. https://doi.org/10.1016/j.eurpolymj.2010.12.011.
- [14] A. Etxabide, R.D.C. Ribeiro, P. Guerrero, A.M. Ferreira, G.P. Stafford, K. Dalgarno, K. De La Caba, P. Gentile, Lactose-crosslinked fish gelatin-based porous scaffolds embedded with tetrahydrocurcumin for cartilage regeneration, International Journal of Biological Macromolecules 117 (2018) 199–208. https://doi.org/10.1016/j.ijbiomac.2018.05.154.
- [15] R. Xu, H. Xia, W. He, Z. Li, J. Zhao, B. Liu, Y. Wang, Q. Lei, Y. Kong, Y. Bai, Z. Yao, R. Yan, H. Li, R. Zhan, S. Yang, G. Luo, J. Wu, Controlled water vapor transmission rate promotes wound-healing via wound re-epithelialization and contraction enhancement, Sci Rep 6 (2016) 24596. https://doi.org/10.1038/srep24596.
- [16] M. Aleemardani, Z. Bagher, M. Farhadi, H. Chahsetareh, R. Najafi, B. Eftekhari, A. Seifalian, Can Tissue Engineering Bring Hope to the Development of Human Tympanic Membrane?, Tissue Engineering Part B: Reviews 27 (2021) 572–589. https://doi.org/10.1089/ten.teb.2020.0176.
- [17] S. Van Der Jeught, J.J.J. Dirckx, J.R.M. Aerts, A. Bradu, A.G. Podoleanu, J.A.N. Buytaert, Full-Field Thickness Distribution of Human Tympanic Membrane Obtained with Optical Coherence Tomography, JARO 14 (2013) 483–494. https://doi.org/10.1007/s10162-013-0394-z.
- [18] X. Yao, B.M. Teh, H. Li, Y. Hu, J. Huang, C. Lv, S. Bu, M. Zheng, Y. Shen, Acellular Collagen Scaffold With Basic Fibroblast Growth Factor for Repair of Traumatic Tympanic Membrane Perforation in a Rat Model, Otolaryngol.--Head Neck Surg. 164 (2021) 381–390. https://doi.org/10.1177/0194599820938345.
- [19] T. Esteban, N.M. Atucha, J.M. Moraleda, J. García-Estañ, C.L. Insausti, J. Moraleda-Deleyto, Chronic model of tympanic perforation in rats with mitomycin C and dexamethasone, Journal of Otology 14 (2019) 12–16. https://doi.org/10.1016/j.joto.2018.11.002.
| Nombre | Ainhoa Irastorza |
|---|---|
| Empresa | Unidad de Terapias Avanzadas, IIS BioGipuzkoa-Hospital Universitario Donostia. Servicio Vasco de Salud - Osakidetza. |
| Cargo | Investigadora postdoctoral |
Si continúas navegando, aceptas su uso.
Más información
Política de privacidad | Cookies | Aviso legal | Información adicional| miembros de CEDRO









































