Diagnóstico por imagen ayudado por IA: marco regulatorio y evolución en el desarrollo
La evolución de la medicina necesariamente irá de la mano de la biotecnología, la bioinformática, y los avances computacionales. En este contexto, introducir sistemas de IA que apoyen y agilicen el proceso diagnóstico ya es una realidad, siendo el departamento de imagen médica el que más cabe beneficiarse de esta tecnología. No obstante, la Inteligencia Artificial sigue siendo un gran desconocido, que genera desconfianza tanto entre profesionales del campo como la población general.
En este artículo intentaremos acercar al lector a la teoría del análisis de imagen basado en IA, subrayando el reto regulatorio que supone la inclusión de un componente decisor no humano en la salud de las personas.
Debemos empezar entendiendo las imágenes médicas como información. Si pensamos en una imagen en blanco y negro, podemos expresarla simplemente como una función f(x,y) que da un valor de gris a cada punto x, y del plano, para crear una superficie definida por una escala de grises en dos dimensiones. Por otro lado, como bien imaginó McCarthy y previo desarrollo de McCulloch y Pitts en 1943, la sinapsis neuronal de los humanos viene dada por un impulso eléctrico, cuya propagación tiene un sentido, y cuyo objetivo es la toma de una decisión (entendida como la respuesta adecuada al estímulo). De esta forma, la actividad cerebral y de procesamiento humano debe venir descrita por una relación lógica, una señal, una función, que caracterice de forma no ambigua su comportamiento. Así se cimienta la creación de redes neuronales para el análisis de datos.
Por tanto, las redes neuronales artificiales simulan su paralelo biológico de la siguiente forma:
-
Se crean una serie de nodos o neuronas (nos referiremos a ellas indistintamente) conectadas entre sí (en forma de “feedforward” o “feedback”). A cada nodo se le va asociar un peso w (de “weight”) que representará la importancia de la información que está llegando a este nodo respecto a los otros. Así, estos pesos se actualizarán al finalizar cada ronda de entrenamiento de forma que se minimice el error entre la información que se ha predicho con la red y la realidad. La repetición de este proceso con distintos datos es el entrenamiento y aprendizaje.
-
A la entrada, tendremos la imagen, un conjunto de píxeles o señal definida por f(x,y). Esta información (todavía bidimensional) pasa a la llamada red convolucional donde se realiza el procesamiento, que consiste en una combinación de convoluciones, submuestreado (pooling) y aplanamiento (“flatten”) que consigue expresar las características importantes de la imagen en un solo vector.
-
A cada neurona (salvo en la primera capa de entrada) llegará la suma ponderada de la información de todos los nodos anteriores. Este sumatorio será el valor de excitación, y su símil biológico sería el estímulo.
-
Este valor de excitación (dependiente de los pesos) pasará a la función de activación que será no lineal para aportar complejidad al sistema. Esta función convertirá el resultado de la excitación en información útil; intrared, la función más usada es ReLU. El símil biológico de este proceso sería la sinapsis. Llegamos a la última capa de nodos, en la que se da el mismo proceso que en las demás, sin embargo, la función de activación que devuelve los valores finales que darán lugar a la decisión es la Softmax (generalmente, si no es una decisión binaria), que devuelve por cada neurona un valor en forma de probabilidad. El símil biológico: la toma de decisión.
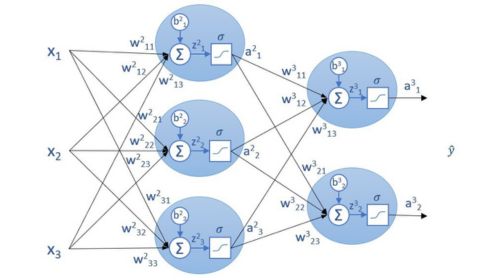
Cabe destacar que esta es una explicación muy simplificada, en un ejemplo real podríamos distinguir la ya mencionada red convolucional y la red densa (“Fully Connected”) donde se toman las decisiones (Figura 1).
Como este sistema puede resultar complejo y abstracto, lo ilustraremos con un ejemplo. Digamos que tenemos las imágenes de RM de un paciente del que se sospecha que puede presentar un tumor maligno. Supongamos también, que el ordenador del médico cuenta con un programa basado en una red neuronal ya entrenada. Al pasar las imágenes a este programa, tras un procesamiento, en el que tras una serie de convoluciones se reconocerán bordes, regiones y características destacables o diferenciadoras de la imagen; a continuación, se reducirá el tamaño de la imagen (“pooling”); y se vectorizará, de forma que quedará caracterizada por un solo vector.
La información está preparada para entrar en la etapa densa de la red, formada de tantas capas como complejidad requiera el problema. A cada nodo llega la información ponderada de los anteriores (excitación) y saldrá información útil y no lineal gracias a la función de activación. Finalmente, en este ejemplo podríamos tener una capa final con dos neuronas, representando que el tumor sea maligno o no. El proceso es el mismo que en las capas anteriores, y como la decisión es binaria, se aplicará la función de activación Sigmoid, que devolverá 0 si el tumor no es maligno y 1 si sí.
En este contexto, un producto de diagnóstico por imagen ayudado por IA podría englobarse en el ámbito de los productos sanitarios, bien sea como producto de base software o bien equipamiento de diagnóstico con software. En este ámbito nos movemos en un ambiente altamente regulado donde el cumplimiento de la normativa hace elevar los requisitos reglamentarios del producto y el nivel de documentación a elaborar, que a menudo suele ser el punto negro de los fabricantes. Todo ello debido al aumento de la regulación y a los requisitos y detalle de la documentación a presentar.
Al tratarse de productos sanitarios, siguiendo el camino de un producto de base o software o bien equipo con software ambos provisto de IA obligatoriamente hay que pasar por la autoridad sanitaria competente, en el caso de España la AEMPS, y el Organismo Notificado correspondiente, para dar cumplimiento al Reglamento de 2017/745 o 2017/746. Abordando el reglamento surgirán múltiples normas a cumplir relacionadas con los puntos siguientes, algunas pero no todas serían:
-
Sistema de Calidad: ISO 13485 y Gestión de Riesgos ISO 14971
-
Verificación de software: fase preclínica y clínica, donde se debe retar el algoritmo formulado para dar lugar a la IA y demostrar la validez de los datos y resultados
-
Validación de Software: ISO 62304 a fin de demostrar la robustez del sistema y fiabilidad de los datos
-
Requisitos de la IA: Reglamento Europeo 2024/1689/UE y Real Decreto 817/2023, a fin de dar cumplimiento legal a la IA
Con la finalidad de conseguir un producto que, bajo la Gestión de Riesgos, cumpla la normativa aplicable y sea certificable. Sin duda, la revolución de la IA está entre nosotros y el ámbito sanitario no podía ser diferente: “la revolución ha llegado”. No obstante:
-
¿Cuán preparados están las autoridades y organismos certificadores?
-
¿Es posible certificar un producto en constante evolución?
La utilidad de la IA ha sido ampliamente probada a través de numerosos estudios, no obstante, existen diversos obstáculos tanto matemáticos como regulatorios que impiden su total integración en la medicina. Debemos asegurarnos de poder resolver sesgos inherentemente asociados a los datos, como la subrepresentación de razas y género; garantizar la capacidad de generalización de la Inteligencia Artificial, ya que, como las personas, puede desarrollar “malos hábitos” al acostumbrarse a los datos de entrenamiento; solucionar el problema de “caja negra”, denominado así porque , las redes son tan complejas que no es posible entender cómo se ha llegado a la decisión; y, por supuesto, no nos olvidamos de lo más importante, el componente humano, no es posible imaginar la introducción de esta tecnología sin la garantía absoluta de que primero y ante todo se vela por la seguridad del paciente.. Este último, como demuestran los retos regulatorios que supone, podría ser el obstáculo más complicado de esquivar.
Referencias
- Duda, Richard O., Edward H. Shortliffe, and Expert Systems Research. 1983. “Expert Systems Research.” Science 220: 261-268. doi:10.1126/science.6340198.
- Falconi, Mariano L., Martina Aineseder, Diego Pérez de Arenaza, María Agustina Ricci Lara, Sonia Benítez, y Walter Masson. 2024. «Inteligencia artificial. Aplicación en las imágenes cardiovasculares y.» Revista Argentina de Cardiología. doi:https://doi.org/10.7775/rac.es.v92.i1.20727.
- Ferrante, Enzo. 2021. «Inteligencia artificial.» Nueva Sociedad (294): 27-36. https://biblat.unam.mx/es/revista/nueva-sociedad/articulo/inteligencia-artificial-y-sesgos-algoritmicos-por-que-deberian-importarnos.
- González, Gabriel Felipe Jaramillo. 2009. «Redes neuronales aplicadas al análisis de imágenes para el desarrollo de un prototipo de un sistema de seguridad.»
- McCarthy, John, Marvin L Minsky, Nathaniel Rochester, and Claude E Shannon. 2006. “A Proposal for the Dartmouth Summer Research Project on Artificial Intelligence.” AI Magazine 27 (4): 12, 13, 14. doi: https://doi.org/10.1609/aimag.v27i4.1904.
- Troilo, Fernando, y Mariano Albertolli. 2022. «Impacto de la Inteligencia Artificial en el perfil del Especialista en Diagnóstico por Imágenes y desafíos de las organizaciones privadas de Salud.» Revista Científica de UCES 27 (2). https://publicacionescientificas.uces.edu.ar/index.php/cientifica/article/view/1338.
| Nombre | Abi Mical Pérez González | Mónica Silvia Fernández Balanzategui |
|---|---|
| Empresa | Konexio Biotech |
| Cargo | Calidad y Compliance | Prácticas |
Si continúas navegando, aceptas su uso.
Más información
Política de privacidad | Cookies | Aviso legal | Información adicional| miembros de CEDRO









































