Espectrometría Raman en la reacción de transcripción in Vitro: Una revolución en el control de procesos
La adaptación técnica y traducción de este articulo ha sido realizada por Marco Barrio de Santa Ana (HYPERLINK "mailto:marco.barrio-de-santa-ana@merckgroup.com"marco.barrio-de-santa-ana@merckgroup.com), MSAT de Merck Life Science.
El articulo ha sido revisado por Iñigo de la Fuente (HYPERLINK "mailto:inigo.delafuente@merckgroup.com"inigo. delafuente@merckgroup.com), Emerging Biotech Consultant de Merck Life Science. Este articulo se basa en un trabajo publicado por: Laurens Vergauwen, Hadi El Radi, Nathan Gay, Kévin Grollier, Johan Cailletaud - Merck KGaA, Darmstadt, Germany.
Desde el desarrollo temprano de la química analítica, los científicos han buscado métodos precisos para identificar, caracterizar y cuantificar moléculas químicas. La capacidad de distinguir entre diferentes sustancias y comprender sus propiedades ha sido fundamental para el avance de la ciencia y la industria. Sin embargo, muchas técnicas analíticas tradicionales son tediosas y laboriosas, limitando su aplicabilidad en situaciones que demandan respuestas rápidas y precisas.
Uno de los hitos importantes en este campo es la espectroscopía Raman, descrito por primera vez por Adolf Smekal y comprobado empíricamente por el científico indio C.J.Raman, de quien adquiere su nombre. La espectroscopía Raman se basa en la dispersión inelástica de la luz, donde las moléculas interactúan con la luz y cambian su frecuencia de manera característica. Este cambio en la frecuencia proporciona una "huella dactilar" única de cada molécula, permitiendo su identificación y cuantificación.
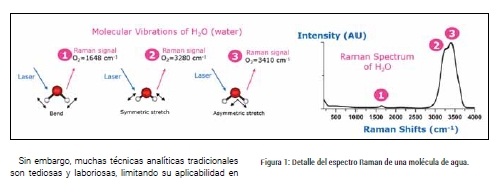
Este efecto se produce gracias al continuo movimiento de los átomos en la molécula, que ocurre en forma de vibración a frecuencias determinadas. Por ejemplo, una molécula de oxígeno (O?) tiene una frecuencia característica de aproximadamente 1550 cm?¹. En el caso de moléculas más complejas, con diferentes átomos, estas tendrán diferentes frecuencias correspondientes a las frecuencias características de sus vibraciones. Al incidir un haz de luz, ocurre la interferencia constructiva de frecuencias iguales, amplificando su longitud de onda. En otras palabras, parte de la luz es absorbida por la molécula, por lo tanto, la luz emitida tendrá una frecuencia diferente. Al detectar este desplazamiento de las frecuencias, es posible obtener un espectro Raman característico de la estructura química del compuesto. En el caso del agua (H?O), hay tres tipos diferentes de vibraciones, lo que resultaría en un espectro de tres picos a diferentes frecuencias (Figura 1).
Desde sus inicios con el uso de arcos de mercurio como fuente de luz, la tecnología Raman ha evolucionado significativamente. La utilización láseres ha mejorado la sensibilidad y la precisión de las mediciones, ya que son capaces de emitir luz a una frecuencia única. En la actualidad, la espectroscopía Raman se ha convertido en una herramienta relevante en diversas industrias, incluyendo la biotecnología, donde se utiliza para monitorear parámetros en biorreactores (niveles de glucosa, ácido acético, etc.) y comienza a encontrar aplicaciones en diversas etapas del “Downstream”. En este artículo nos vamos a centrar en su potencial para monitorizar reacciones químicas y enzimáticas de forma directa y no invasiva.
La reciente demanda de vacunas basadas en ARN mensajero, impulsada por la pandemia de COVID-19, ha incrementado la necesidad de métodos de control más eficientes para la reacción de transcripción in vitro (In Vitro Transcription, IVT). Esta reacción enzimática permite la síntesis de ARN a partir de una plantilla de ADN en un reactor. Esta etapa es crucial y extremadamente sensible a las condiciones del proceso. Identificar el agotamiento de uno de los reactivos, la velocidad de la reacción o el punto óptimo de parada tiene un impacto directo en la productividad de la etapa.
Los métodos analíticos tradicionales "offline" para cuantificar bases NTP (ATP, CTP, GPT y UPT) y ARN son demasiado lentos para un control activo de la reacción. En este contexto, la tecnología Raman ofrece una solución prometedora, ya que proporciona un análisis en línea y en tiempo real de forma no invasiva, lo que podría transformar la forma en que se controla y optimiza este proceso crítico.
Caso Práctico
En este estudio de viabilidad, evaluamos el uso del ProCellics™ Raman Analyzer de Merck para monitorear la disminución de los NTP y la producción de ARN durante la reacción IVT.
Objetivos
- Demostrar una buena precisión para identificar precursores de ARN y ARN mensajero.
- Demostrar una buena selectividad para identificar bases NTP.
- Demostrar una buena capacidad de cuantificación de la concentración de cada componente.
Método y materiales
Para la obtención de los espectros Raman se utilizaron bases NTP purificadas (Sigma-Aldrich®) a diferentes concentraciones (0.89 a 16.67 mM). También se realizaron mezclas de estas con el fin de tener en cuenta posibles interacciones entre bases. Muestras de ARN mensajero de diferentes longitudes fueron proporcionadas por el equipo de innovación de Merck y diluidas en concentraciones de 0.1 a 3.5 g/L. (Figura 2).
Las muestras se analizaron utilizando ProCellics™ Raman Analyzer, y los datos obtenidos se procesaron usando el software Raman PAT Bio4C®. Con el fin de poder realizar medidas de muestras pequeñas (1.5 mL) y sin necesidad de inmersión de la sonda se utilizó un módulo de medida externa (Figura 3, A & B). Todas las muestras fueron medidas con un tiempo de integración Raman de 50 segundos x 3 espectros promedio, resultando en un total de 2 min y 30 segundos por medición (Figura 4).
Análisis de resultados
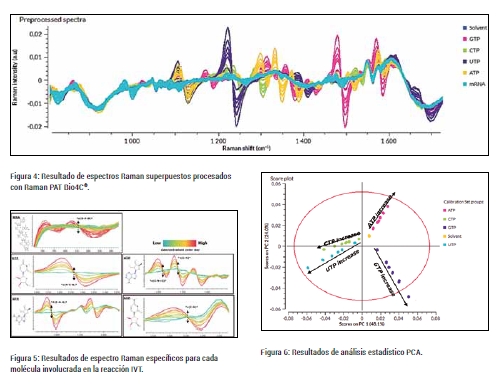
El análisis proporcionó diferentes espectros Raman que fueron procesados utilizando el software Raman Bio4C® PAT para mejorar la señal, eliminar interferencias y destacar las bandas Raman de las moléculas de interés. En la figura 4 se muestra una representación superpuesta de los diferentes espectros Raman obtenidos. En la imagen se puede ver de forma muy visual las diferentes bandas correspondientes a las diferentes vibraciones moleculares para cada molécula, lo que es una prueba fehaciente de la gran especificidad de la tecnología en cuanto a identificación de los diferentes componentes de la reacción IVT.
En la siguiente figura (5) , se ha realizado una representación en específico de cada uno de los componentes (ARN, ATP, CTP, GTP y UTP). Se ha incluido también una escala de azul a rojo para representar las diferentes concentraciones de las muestras. Se puede observar que una menor concentración de la molécula corresponde a una menor intensidad Raman, mientras que una mayor concentración da lugar a una mayor intensidad. Esta relación implica que la amplitud del pico Raman es directamente proporcional a la concentración de molécula presente en la solución. Como se puede observar es posible incluso identificar las vibraciones de algunos enlaces en concreto que aparecen en posiciones únicas de la banda, lo que vuelve a demonstrar la especificidad de la técnica.
Análisis Cualitativo de los resultados: Principal Component Analysis (PCA)
La realización del Principal Component Analysis (PCA) permite condensar la información del espectro en un solo dato. De esta forma podemos tener un punto de vista diferente de nuestro conjunto de datos e identificar patrones o tendencias. El resultado de este ejercicio viene representado en la siguiente figura (6), donde se puede observar en diferentes colores las bases NTP.
Para la observación de este gráfico hay que entender que cuánto más cercanos estén los puntos entre diferentes bases, más compleja va a ser la identificación ya que las bandas Raman serán más parecidas. Al contrario, cuánto más separados se encuentren, significará que las bandas Raman difieren más y serán más fáciles de identificar. En este caso en concreto se pueden ver diferencias claras entre grupos de datos de las diferentes bases, corroborando la buena especificidad del método. De la misma manera, se puede observar un patrón de concentraciones ya que según la concentración aumenta, los puntos se encuentran más alejados del centro siguiendo una tendencia lineal.
Análisis cuantitativo: Regresión de mínimos cuadrados parciales (PLS)
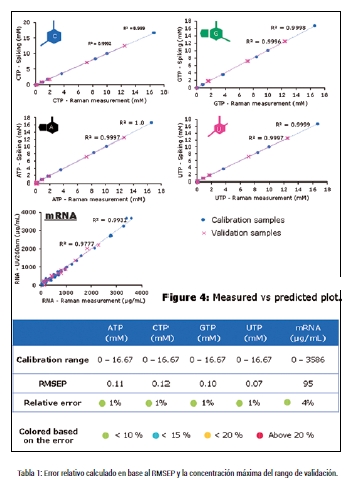
Para determinar la precisión del ProCellics™ Raman Analyzer, se midió un primer conjunto de muestras (conjunto de calibración) para crear modelos de regresión de mínimos cuadrados parciales (partial least squares, PLS). Posteriormente, las regresiones PLS se utilizaron para medir nuevas muestras (conjunto de validación) y así determinar la precisión del modelado. En total, se construyeron cinco modelos PLS, uno para cada NTP y mRNA. Los resultados se muestran en la Figura 6. La linealidad observada en la línea de regresión es excelente y el Error Cuadrático Medio de Predicción (Mean Square Error of Prediction , RMSEP) es de alrededor de 0.1 mM para los NTPs y 95 µg/mL para el mRNA. La Tabla 1 muestra el error relativo calculado en base al RMSEP y la concentración máxima del rango de validación. Cada error relativo se determinó en 1% y 4% para los NTPs y el mRNA, respectivamente.
Conclusiones
En conclusión, la implementación de la espectroscopia Raman demostrada en este estudio abre el camino hacia una nueva solución analítica para controlar las concentraciones de NTPs y ARN mensajero en reacciones de transcripción in vitro con alta precisión y eficiencia. Entre sus principales ventajas se encuentran:
- Correlación directa: Establece una correlación directa entre la amplitud de las señales de pico Raman y la concentración de cada molécula en la solución.
- Especificidad superior: Ofrece una alta especificidad y precisión en la cuantificación de NTP y ARN, lo que garantiza mediciones exactas con cada escaneo.
- Eficiente en el uso de los recursos: No se necesitan consumibles ni disolventes para las mediciones de espectroscopia Raman, lo que la convierte en una solución rentable y sostenible.
- Conservación de muestras: Las mediciones no destructivas de la reacción IVT requieren volúmenes de muestra pequeños, diferenciándola de los métodos tradicionales.
- Cuantificación de múltiples moléculas: La cuantificación simultánea de múltiples moléculas permite un análisis completo en un solo instrumento, ahorrando tiempo y permitiendo una intervención rápida.
- Escalado: Un único método de calibración puede compartirse sin esfuerzo entre instrumentos, lo que proporciona la máxima adaptabilidad para transferencias de tecnología de un sitio a otro, ampliaciones o una mayor eficiencia de producción.
| Nombre | |
|---|---|
| Empresa | Merck Life Science |
| Cargo |
Si continúas navegando, aceptas su uso.
Más información
Política de privacidad | Cookies | Aviso legal | Información adicional| miembros de CEDRO










































