IA generativa integrada en productos sanitarios: navegando en el laberinto legal europeo

Actualmente la integración de la Inteligencia Artificial (IA) generativa en los productos sanitarios es un tema en auge, tanto para innovación como para la mejora sanitaria.
Nos enfrentamos a dispositivos que requieren un marco regulatorio definido para garantizar la seguridad, teniendo en cuenta todos los posibles riesgos asociados a dichos productos.
Sin embargo, este problema no se limita únicamente a la gestión del riesgo, sino que nos surge otra pregunta: ¿Cómo se van a clasificar estos productos sanitarios? ¿De acuerdo con el MDR (Reglamento (UE) 2017/745) o de acuerdo con la nueva normativa de la IA?
Para comprender mejor la clasificación de productos sanitarios, es necesario entender la integración de la inteligencia artificial (IA) en dichos productos (Figura 1):
Actualmente según el MDR los productos sanitarios se clasifican por la finalidad prevista/uso previsto.
Los programas informáticos son considerados productos sanitarios con algunos de los siguientes fines médicos específicos, de acuerdo con el MDR (Figura 2):

Hay que destacar que, si estos programas informáticos se utilizan en ámbito sanitario para usos generales u objetivos de bienestar o estilo de vida, no son productos sanitarios.
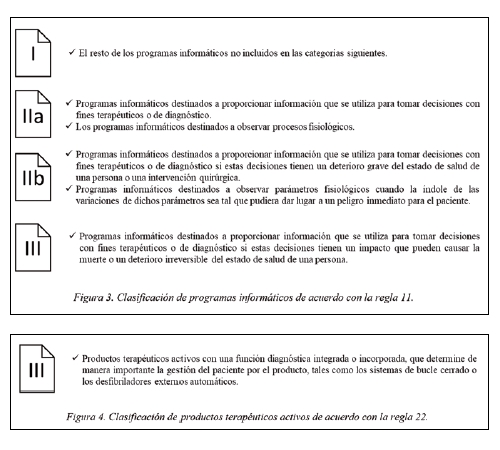
Estos programas informáticos dentro de la clasificación del MDR se consideran un PRODUCTO ACTIVO. Dentro de la clasificación de los productos activos del reglamento, es la Regla 11 la que clasifica estos programas informáticos, clasificados de la siguiente forma (Figura 3):
Según la propuesta del Consejo Europeo y el Parlamento Europeo, para establecer normas armonizadas sobre la inteligencia artificial (Ley de inteligencia artificial), en lo que respecta a los sistemas de IA que son componentes de seguridad de productos sanitarios o productos sanitarios para diagnóstico in vitro, o que son ellos mismos productos, es apropiado clasificarlos como de alto riesgo:
Además, tenemos la Regla 22 (Figura 4):
(30) As regards AI systems that are safety components of products, or which are themselves products, falling within the scope of certain Union harmonisation legislation listed in Annex II, it is appropriate to classify them as high-risk under this Regulation if the product in question undergoes the conformity assessment procedure with a third-party conformity assessment body pursuant to that relevant Union harmonisation legislation. In particular, such products are machinery, toys, lifts, equipment and protective systems intended for use in potentially explosive atmospheres, radio equipment, pressure equipment, recreational craft equipment, cableway installations, appliances burning gaseous fuels, medical devices, and in vitro diagnostic medical devices.
Ambas reglamentaciones como hemos visto clasifican de forma diferente y esto supone una problemática. Veamos a continuación varios casos hipotéticos de softwares que incorporan modelos de IA.
1. Producto sanitario software que incorpora un modelo de IA para gestionar automatizadamente la información clínica con fin diagnóstico o terapéutico
En los sistemas de salud digitalizados, el expediente médico electrónico (EHR) es una fuente importante de información en la que los médicos confían para el tratamiento de los pacientes. Por lo tanto, es importante que el EHR contenga información actualizada y correcta. Para asegurar que el EHR contenga la información relevante, los médicos deben registrar manualmente la información recopilada durante cada encuentro con un paciente en la práctica. Se sabe que el proceso de registrar información del paciente en el EHR consume mucho tiempo para los médicos, ocupando una parte significativa de su jornada laboral.
Para reducir el tiempo y mejorar la integridad de la información registrada, se puede aplicar un sistema de IA para la documentación automatizada. Utilizando un sistema de reconocimiento de voz basado en IA puede escuchar la consulta con el paciente e introducir automáticamente información en el EHR.
Entre otros riesgos, cada vez que un EHR incorpora información incorrecta o incompleta, existe la posibilidad de que se desencadene un error médico, puesto que el personal médico puede tomar decisiones diferentes a las que habrían tomado si la información en el EHR hubiera sido correcta.
Este producto sanitario, es un software “destinado a proporcionar información que se utiliza para tomar decisiones con fines de diagnóstico o terapéuticos”, por lo que de acuerdo con la Regla 11 del MDR se clasifica en la clase IIa, un producto de riesgo moderado.
De acuerdo con la Ley de IA, al ser un producto sanitario clase IIa y, por tanto, certificable por un Organismo Notificado mediante el procedimiento establecido en los anexos IX a XI del MDR, este producto sería clasificado como producto de alto riesgo.
2. Producto sanitario que personaliza la dosis de quimioterápico a administrar en cada paciente
Imaginemos un producto sanitario innovador diseñado para mejorar la precisión y la eficacia del tratamiento con quimioterapia en pacientes con cáncer. Este producto utiliza IA y análisis de datos para determinar la dosis óptima de quimioterapia para cada paciente de manera individualizada.
El proceso comienza cuando el sistema captura la información del paciente, incluyendo datos demográficos, resultados de pruebas de laboratorio, imágenes médicas, historial médico y características específicas del tumor. El producto procesa esta información utilizando algoritmos de IA avanzados y genera una recomendación personalizada sobre la dosis de quimioterapia más adecuada a administrar para el paciente en particular.
Planteemos que el médico no revisa esa dosis, sino que es el propio producto está conectado a un sistema de infusión continua y controla la velocidad de perfusión del suero preparado con el fármaco quimioterápico.
El riesgo aquí es inminente, ya que una dosis incorrecta de quimioterapia podría resultar en la muerte del paciente.
De acuerdo con la Regla 22 del MDR, “los productos terapéuticos activos con una función diagnóstica integrada o incorporada, que determine de manera importante la gestión del paciente por el producto, tales como los sistemas de bucle cerrado o los desfibriladores externos automáticos” se clasifican como Clase III.
De acuerdo con la Ley de IA, sería clasificado como producto de alto riesgo.
Aquí la clasificación con ambas reglamentaciones es coincidente.
3.Producto sanitario software que incorpora un modelo de IA para gestionar de forma automatizada la monitorización de un parámetro físico vital
Supongamos que desarrollamos un producto sanitario software de carácter innovador diseñado para agilizar y mejorar el registro de parámetros físicos (peso, índice masa corporal) en entornos médicos. Este producto utiliza IA para recopilar y presentar de manera precisa y eficiente el histórico de datos sobre los signos de los pacientes.
El producto software se embebe en un producto sanitario hardware utilizado para medir los parámetros físicos, como la presión arterial, la frecuencia cardíaca, la saturación de oxígeno y la temperatura corporal.
En este caso según el MDR Regla 11, sería Clase I, ya que es un producto que por su propósito no cumple ninguno de los requisitos establecidos para los productos clasificados como Clase IIa o superior.
De acuerdo con la Ley de IA, sería clasificado como producto de alto riesgo, ya que incluye un modelo de IA que se utiliza en productos sujetos a la legislación de la UE sobre seguridad de los productos (Directiva 2001/95/CE).
Aquí la clasificación con ambas reglamentaciones es totalmente contradictoria.
Esta discrepancia entre un reglamento y otro que hemos contemplado con algunos ejemplos hipotéticos se puede solventar, apoyándonos en ambas regulaciones, como veremos más adelante.
Pero ¿Y si tenemos un producto innovador y no disponemos de marcado CE?
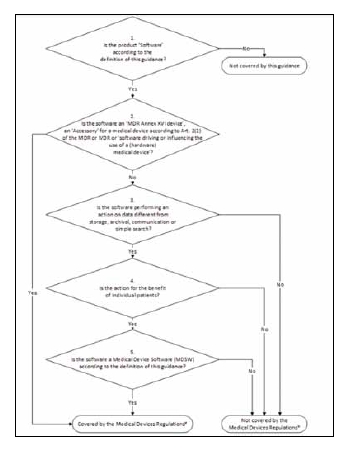
La Guía del MDCG sobre la Calificación y Clasificación de Software, 2019-11, nos proporciona ayuda al respecto. Incluye un diagrama de flujo (Figura 5) que nos permite establecer que un software de dispositivos médicos (MDSW) está regulado bajo el MDR.
La propuesta de Ley de IA permite optar por el marco legislativo actual, el MDR, apoyándose en la Ley de IA para abordar requisitos más técnicos de manera más precisa:
(42) To mitigate the risks from high-risk AI systems placed on the market or put into service and to ensure a high level of trustworthiness, […] the general rule is that several pieces of the EU legislation may have to be taken into consideration for one product, since the making available or putting into service can only take place when the product complies with all applicable Union harmonisation legislation. […] This however should not in any way undermine the obligation of the provider to comply with all the applicable requirements.
Sin embargo, el MDR no es un marco regulatorio adecuado para productos que incorporan modelos de IA Generativa (GenAI). Tal y como indica la Guía del MDCG 2020-3, se considera que un producto sanitario software experimenta un cambio significativo y pasa a ser un producto susceptible de ser nuevamente certificado por parte de un Organismo Notificado, cuando experimenta una modificación en el algoritmo. Teniendo en cuenta que un MDSW que incorpora GenAI es un producto que experimenta cambios significativos de una manera continuada, y que el periodo de tiempo que invierte un organismo notificado en realizar una auditoría para certificar el producto sanitario es de entre 13-18 meses, sería inviable que un Organismo Notificado pueda asumir la certificación de este tipo de producto sanitario.
Este aspecto se debería tener en cuenta en el proceso de revisión del reglamento MDR, que se inicia este año 2024.
En conclusión, la integración de la IA generativa en productos sanitarios es una realidad cada vez más cercana y disponer de una reglamentación es fundamental para garantizar la seguridad y eficacia de dichos productos.
En la próxima Newsletter hablaremos sobre como mitigar y evaluar la eficacia de las medidas de mitigación de riesgos que son exclusivas de productos sanitarios software que incorporan modelos de IA.
| Nombre | Angela López Lorca y Miguel Ángel Campanero |
|---|---|
| Empresa | A3Z Advanced |
| Cargo | Biochemistry / Quality Assurance y General Manager, respectivamente |
Si continúas navegando, aceptas su uso.
Más información
Política de privacidad | Cookies | Aviso legal | Información adicional| miembros de CEDRO









































