La inmunidad como esperanza continuamente novedosa
DESARROLLO DE LA INMUNOTERAPIA A TRAVÉS DEL CONOCIMIENTO DE SUS MECANISMOS DE ACTUACIÓN
Pocos hitos ha habido hasta la actualidad en la historia del tratamiento del cáncer. El primer intento terapéutico fue el más evidente, la cirugía. Pero rápidamente se evidenció que los tratamientos locales y loco-regionales fallaban como terapia para evitar tratar la enfermedad diseminada.
La quimioterapia apareció después de la primera guerra mundial tras la observación de que los soldados expuestos al gas mostaza perdían sus ganglios linfáticos. Este dramático nacimiento de la ‘quimioterapia’ llevó a un desarrollo extraordinariamente empírico y frustrante dada su toxicidad y escasa eficacia. Pero tras haber observado que algunos tumores como los hipernefromas y melanomas experimentaban ocasionalmente regresiones espontáneas, se ha quedado en la memoria colectiva de la oncología la posibilidad de ayudar al propio organismo a acabar con la enfermedad. El tratamiento con proteínas de los tumores ha sido un sueño perseguido durante muchos años.
En 1966 se publicaron (Everson T, Coley WH. Spontaneous regression of cancer. Filadelfia: Saunders, 1966) un total de 176 casos de remisiones espontáneas y así dieron el pistoletazo de salida a algo que ya se conocía desde el año 1550 a.C., acerca de que algunas infecciones podían excepcionalmente provocar remisiones tumorales (el médico egipcio imhotep trataba los tumores con una cataplasma seguida de una incisión). Posteriormente se dieron varios intentos con esta misma filosofía. William Coley, a finales del siglo XIX, empleó un cocktail de bacterias (Streptococcus pyogenes y Serratia marcescens); posteriormente, en 1920, se descubrió la utilidad de la BCG para evitar la TBC en la ganadería; y más tarde, en 1970, se aprobó como inmunoterapia para el tratamiento del cáncer de vejiga. ¿Se conocía su mecanismo de acción? Obviamente no, el desarrollo de la inmunoterapia había sido eminentemente empírico, pero el desarrollo exponencial que ha tenido el conocimiento de la biología molecular ha permitido empezar a entender mejor todo lo relacionado con la inmunidad.
¿Qué hemos aprendido?
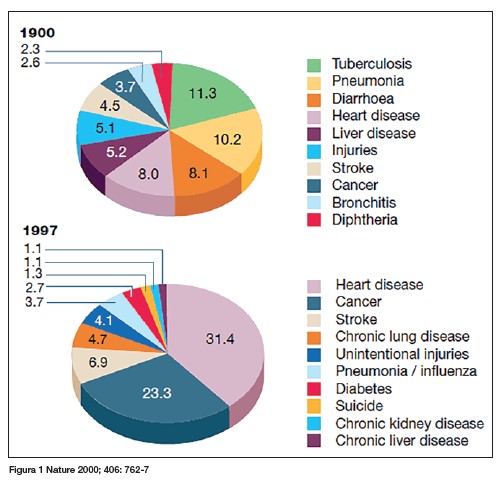
Lo primero que la observación nos ha enseñado es la naturaleza real del cáncer, que es una enfermedad degenerativa. Cohen mostró cómo la eliminación de las primeras causas de muerte de principios de siglo (fundamentalmente infecciosas) conllevó a un incremento de la edad media de la población en EEUU y a la aparición del cáncer entre las primeras causas de muerte (figura 1). Comparando las causas de muerte entre 1900 y 1997 se ve que prácticamente ha desaparecido la tuberculosis, las neumonías, las diarreas y las enfermedades hepáticas, que eran la causa de casi el 35% de los fallecimientos.
La biología ha confirmado ese dato empírico: los cambios en el patrón de metilaciones, el acortamiento de la longitud de los telómeros y las inflamaciones estériles que se producen con el agotamiento de las células stem da lugar a la aparición de tumores. Se ha observado, además, que las células tumorales no son demasiado distintas de nuestras células normales y nuestro sistema inmune está diseñado para eliminar lo muy distinto y para tolerarnos a nosotros mismos.
Por tanto, el sistema inmune ha eliminado en el timo, por un mecanismo que se ha llamado ‘selección negativa’, los linfocitos con alta afinidad para los antígenos que expresan nuestras propias células y así eliminar los que puedan provocar una enfermedad autoinmune (figura 2).
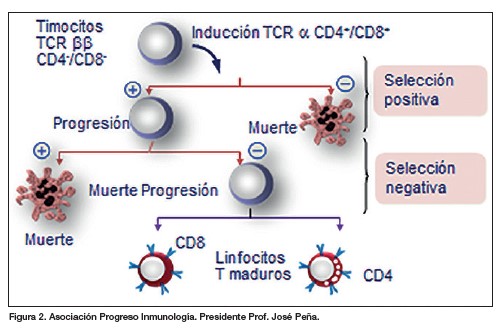
No obstante, para evitar cierto grado de anergia no se pueden eliminar los linfocitos de baja afinidad. Para mantener un equilibrio entre anergia/autoinmunidad, el sistema inmune ha desarrollado un complejo sistema de ‘frenos’ y ‘aceleradores’ sobre los que hemos aprendido a actuar a través de los anticuerpos monoclonales (MoAb por sus siglas en inglés), tanto en los linfocitos, como en las células presentadoras de antígenos (figuras 3 y 4).

Estos frenos y aceleradores se enmarcan en el ciclo del cáncer y su relación con la inmunidad: células tumorales que se mueren espontáneamente liberan antígenos que son fagocitados por las células presentadoras de antígenos (APC por sus siglas en inglés), que a su vez se relacionan directamente con los linfocitos T citotóxicos (CD8+), los linfocitos T helper (CD4+) y los linfocitos T reguladores (CD4+) (figura 5).
.jpg)
Además, hemos aprendido sobre el papel de las distintas citoquinas en el mantenimiento y en la diferenciación de las distintas sub-clases de linfocitos.
¿Qué es lo que ha hecho la inmunoterapia tan atractiva?
Se puede decir que ha sido el paradigma de la investigación básica aplicada, la investigación traslacional y esto es así porque tanto sus mecanismos de acción como sus efectos secundarios han podido ser claramente explicados, incluso son fácilmente previsibles. Además, se puede decir que se han descrito fármacos con mecanismos de acción únicos: actúan sobre un único punto y sobre uno o unos pocos tipos de células. Esto no ocurre con la quimioterapia, que actúa sobre la mayoría de las células, y en la mayor parte de los casos tiene múltiples mecanismos de acción; y tampoco ocurre de una forma clara con los inhibidores de la Tirosin Kinasa.
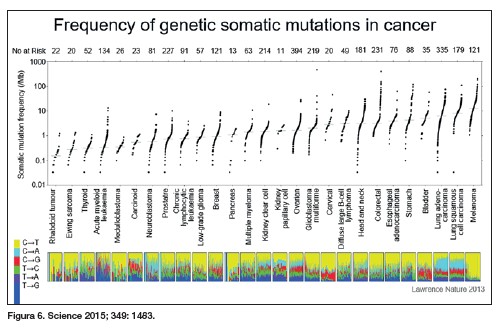
Si nos centramos en los tumores poco mutados podemos ver que la inmunoterapia no es activa, y esto tiene una lógica indiscutible: los tumores poco mutados expresan proteínas no demasiado alteradas por lo que el sistema de vigilancia no las detecta como ajenas y los linfocitos capaces de detectar esas pequeñas alteraciones han sido eliminados en el proceso de ‘selección negativa’. Y a la inversa, los tumores muy mutados como el melanoma, tienen un porcentaje alto de remisiones espontáneas y son muy sensibles a la inmunoterapia (figura 6).
Evidentemente no es todo tan sencillo porque el ambiente intratumoral puede llegar a ser inmunosupresor. Dos ejemplos: el cáncer de colon produce un ambiente en el que los linfocitos se encuentran rodeando los nichos de tumor y en el cáncer de páncreas simplemente hay una ausencia de linfocitos, por eso se ha llegado a llamar desierto inmunológico. El conocimiento de estos datos nos ha llevado a discurrir estrategias terapéuticas de futuro que veremos más adelante.
Historia contemporánea
El primer gran hito de la inmunoterapia de la era moderna no llega hasta que en 2010 empiezan a publicarse los datos de Ipilimumab en el melanoma metastásico. Este es un fármaco que inhibe uno de los frenos de la respuesta inmune, CTLA4 (figura 7).
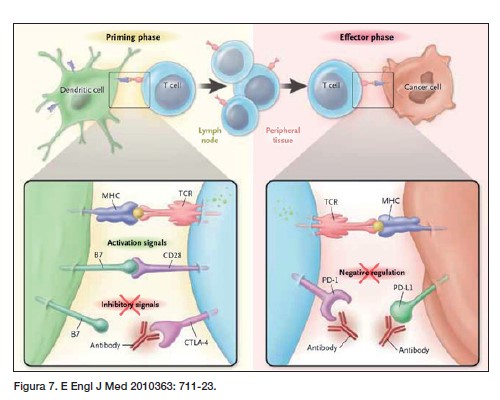
Una vez que los linfocitos T helper (TH) han sido activados por las células presentadoras de antígenos (antígenos tumorales o microbianos) comienzan a expresar CTLA4 como mecanismo regulador de la respuesta. Si este mecanismo se inhibe, se produce una respuesta exagerada. Los TH migran a los ganglios y allí secretan citoquinas, entre otras la interleukina-12 (IL-12). En respuesta a esas moléculas los linfocitos se expanden y entre otras cosas, activan los linfocitos T citotóxicos (TC) que serán los encargados de eliminar las células tumorales.
Cuando a finales de la década de los 80 se empleaba IL-12, a dosis altas se observaba un síndrome de hiperpermeabilidad vascular, que producía edema pulmonar, conocido como el ‘leak syndrome’.
Actualmente, como producto de la salida de citoquinas se ve un fenómeno similar que se ha llamado tormenta de citoquinas. Este se produce con más frecuencia en el uso de anti-CTLA4 que con los anti- PD1/PDL1, porque la liberación de citoquinas es la forma por la que los TH interactúan con el resto del sistema inmune, tanto con las células B como por los linfocitos TC.
El siguiente hito fue el bloqueo de la unión de los receptores PD1 de los linfocitos TC con el PD-L1 de las células tumorales. Esa unión es un nuevo punto de control del sistema inmune para evitar la enfermedad autoinmune. Los PD-L1 están expresados en todas las células del organismo y si el PD1 de un linfocito TC encuentra un PD-L1 de una célula a quien unirse, recibe una señal de apoptosis para no eliminar la célula ‘amiga’.
El conocimiento basico de la inmunidad y el desarrollo de nuevos fármacos
Hemos visto en la figura 3 que existen señales inhibitorias y activadoras en los linfocitos (‘helper’ o ‘supresores’). Las funciones potenciales de los MoAb están relacionadas con la actividad intrínseca de los receptores a los que se unen, pero además, esa actividad puede desarrollarse en el ambiente intra-tumoral (PD1/PD-L1) o fuera de él (CTLA4/CD86, CD80 en las células helper que lo hacen fundamentalmente en los ganglios, como se ve en la figura 4). Por ejemplo, la activación con MoAb de CD40 activaría directamente a los T4 e indirectamente a los T8. Con este mecanismo de acción tendríamos que esperar cierto riesgo de ‘tormenta de citoquinas’ (figura 8).
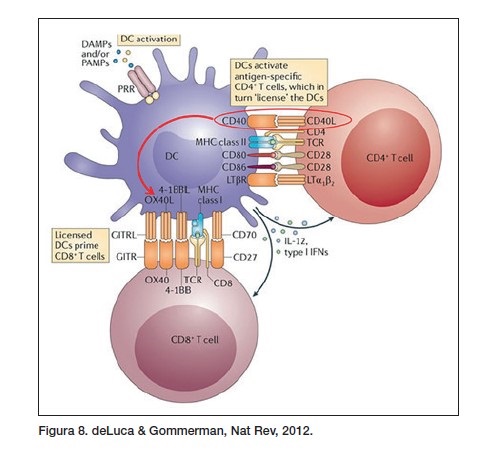
Todo lo que ocurre en el interior de las APC es de suma importancia, pero solo vamos a comentar que esas células han de digerir los antígenos y, posteriormente, expresar sus fragmentos en la superficie celular unidos a antígenos mayores de histocompatibilidad (MHC por sus siglas en inglés). Además, todas nuestras células expresan fragmentos de proteínas propias que, mostradas sobre un MHC, no llegan a unirse a ningún linfocito porque los que eran capaces de hacerlo fueron eliminados previamente en el timo. Las células realizan esta función a través de la maquinaria procesadora de antígenos (APM, por sus siglas en inglés) de la célula.
Esa maquinaria responde de una forma particular a los DAMP (daños asociados a patrón molecular, por sus siglas en inglés) como son los DNA circulares, o el RNA de doble hélice. Por eso, esta ha sido una estrategia para mejorar la presentación de antígenos sobre los MHC. Incluso in vitro se ha llegado a ver un incremento de MHC en la superficie de las APC y de las células tumorales con estas estrategias. Este es un campo de investigación menos ordenado que la inmunoterapia con anticuerpos porque aún no sabemos la causa íntima por la que las APC reaccionan, dirigiendo su capacidad de activación hacia reacciones de hipersensibilidad tipo I, IV o hacia la modulación de T8.
Uno de los problemas con el que nos encontramos es que, aunque la inmunidad sea adecuada y el tumor sea inmunogénico, podría ocurrir que los linfocitos no pudieran llegar al tumor o que en el tumor se desactivaran. Esto ocurre con demasiada frecuencia y es debido a una multitud de factores que se pueden llegar a modificar. Ya se ha comentado en el párrafo anterior que la administración de DAMP podría incrementar la expresión de MHC, y esto es interesante porque su reducción acaba en una expresión insuficiente de epítopos mutados en la superficie de las células.
Además, las células expresan un receptor llamado FasL que se puede unir al Fas de los linfocitos e induce su apoptosis (algo similar a la unión PD1/PD-L1).
En el seno del tumor se produce un incremento de secreción de sustancias inmunoreguladoras: la IL-10 que inhibe los TH, reduce la expresión de MHC, reduce las señales de activación de APC, etc; la PGE2 que inhibe los linfocitos T8 y podría favorecer a los MDSC (myeloid derived stem cell, otra célula reguladora de origen y funcionalidad un tanto misteriosa); la IL-6 y el TGF-β. En el seno del tumor existen macrófagos (los precursores de APC) en estado M2 con función inmunosupresora. Todo este ambiente inmunosupresor es objeto de estudio para su modulación en la medida de lo posible.
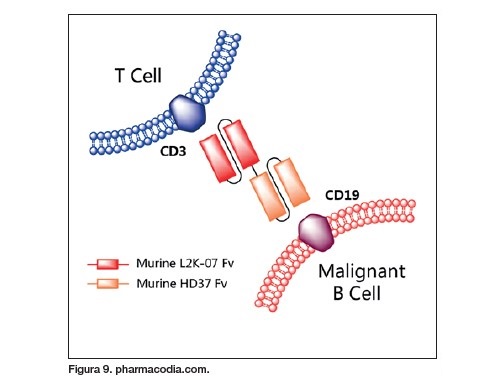
Una de esas estrategias consiste en ‘forzar’ la unión de los linfocitos T8 a la célula tumoral. Para ello se están desarrollando anticuerpos biespecíficos como el blinatumomab, que une el receptor CD19 expresado en células B tumorales con los receptores CD3 de los linfocitos T8 y T4. Evidentemente, aquí el reto radica en seleccionar un receptor lo suficientemente específico de las células tumorales como para limitar la toxicidad e incrementar su eficacia (figura 9).
La terapia celular está ya presente en el mundo (Células CAR, receptor de antígeno quimérico por sus siglas en inglés), aunque aún no se ha expandido más debido a su alto precio, pero ya se están está consiguiendo resultados extraordinarios en leucemias linfoblástica agudas y linfomas.
Básicamente consiste en extraer los linfocitos del paciente, modificar los receptores de los LT para que reconozcan los receptores CD19, que se expresan casi uniformemente en las células tumorales de leucemia linfoblástica, expandirlos y después reinfundirlos al paciente. El problema de que los LT necesitan señales co-estimuladoras (MHC, o CD 28 por ej) se ha solucionado modificando la parte citoplasmática del receptor para que las señales adicionales se produzcan sin la presencia de uniones de otros receptores (figura 10).
.jpg)
Evidentemente esta terapia es eficaz solo si existe una proteína expresada de forma bastante uniforme en las células tumorales y además son escasas en las células normales, o bien si ese grupo celular normal es irrelevante. Esta es una circunstancia rara en las neoplasias que se comportan habitualmente como enfermedades policlonales. Para solucionar esto se están desarrollando células CAR que solo se activan ante la presencia simultánea de dos receptores distintos, con lo que se incrementaría su especificidad de acción.
A modo de conclusión, esta terapia es tan poderosa que puede producir problemas severos de autoinmunidad. Incluso una vez ctivada la reacción, podría ser difícil de controlar/revertir. Para ello se están dotando a esas células de mecanismos de autodestrucción que puedan activarse en presencia de una señal. Por ejemplo, in vitro se podría introducir el gen UL97 (que es el gen que tienen los virus para fosforilar el ganciclovir y transformarlo en una sustancia tóxica). En caso de una enfermedad autoinmune severa se podría administrar este fármaco al paciente para destruir las células CAR.
Como resumen de lo expuesto podemos decir que el desarrollo de la inmunomodulación está reduciendo el empirismo en los tratamientos antitumorales de una forma creciente. Las dificultades para estudiar invitro estos agentes terapéuticos se ha visto ampliamente superada por el beneficio terapéutico y por su capacidad de predecir toxicidades.
Podemos decir que ha comenzado una nueva era en el tratamiento del cáncer.

| Nombre | José María Viéitez |
|---|---|
| Empresa | Pivotal |
| Cargo | Director médico oncología |
Si continúas navegando, aceptas su uso.
Más información
Política de privacidad | Cookies | Aviso legal | Información adicional| miembros de CEDRO










































