Terapias avanzadas: Equipos y plataformas automatizadas para su producción

Las terapias avanzadas representan un avance revolucionario en el campo de la medicina contemporánea, ofreciendo nuevas esperanzas para el tratamiento de enfermedades genéticas, cáncer y diversas condiciones degenerativas.
Según la Sociedad Americana de Terapias Génicas y Celulares (ASGCT) [1], actualmente hay más de 4000 terapias celulares, genéticamente modificadas o no, en desarrollo, pero a pesar de esto, sólo 100 han sido aprobadas globalmente para uso clínico. Asimismo, a pesar del gran potencial de esta tecnología, la aprobación y producción de estas terapias enfrenta desafíos importantes. Las terapias celulares deben garantizar alta seguridad y eficacia, cumplir con complejos requisitos de calidad y enfrentar procesos de fabricación costosos, con un precio medio de producción de un millón de dólares americanos por tratamiento [2].
Este tipo de terapias empezaron a producirse de forma totalmente manual debido a la ausencia de equipos automáticos, el bajo volumen requerido para estas terapias y su producción por paciente. Aunque esta metodología es válida para el desarrollo de estas terapias y proporciona el material necesario para ensayos clínicos, la creciente demanda que ha habido en los últimos años hace que sea insuficiente para una producción a mayor escala de este tipo de fármacos. Adicionalmente, la producción manual también conlleva un mayor riesgo de variabilidad y errores humanos, lo cual es crítico en estos tratamientos, pudiendo afectar la calidad del producto final.
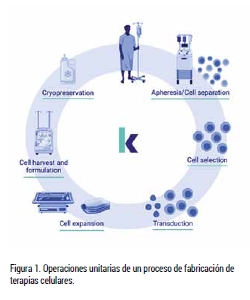
Estas terapias, aunque complejas, deben seguir estrictas normas de correcta fabricación (GMP) para garantizar la calidad y la seguridad del paciente. Navegar por este marco regulatorio puede ser un desafío, especialmente si se utilizan procesos manuales. Actualmente, existen en el mercado gran cantidad de equipos que permiten la automatización de todos los procesos necesarios para la fabricación de este tipo de terapias, evitando así la posible variabilidad asociada a la manipulación humana. Si bien es verdad que no existe un único equipo capaz de realizar de forma autónoma la totalidad del proceso, sí es posible conectar entre sí varios equipos que realizan operaciones unitarias para poder automatizar gran parte del proceso.
Existen dos grandes tipologías de cultivos celulares, según la fuente de dónde se extraigan las células usadas para este tipo de terapias. Las células en suspensión, como, por ejemplo, las terapias basadas en CAR-T o NK, y las células adherentes, como por ejemplo todas las terapias derivadas de células mesenquimales. Estas diferencias determinarán la tecnología de cultivo a aplicar durante los pasos de expansión celular, sin embargo, el resto de las operaciones serán comunes para las dos tipologías.
A continuación, se presentan algunos de los equipos disponibles en la industria para cubrir las necesidades de cada una de las etapas unitarias del proceso, representadas en la Figura 1. Se describen primero los equipos dedicados a cubrir individualmente cada una de estas operaciones y, a continuación, se describen los equipos más avanzados o de nueva generación que incorporan múltiples pasos en un solo equipo cerrado y automatizado.
El primer paso en el desarrollo de las terapias celulares es la obtención de las células primarias. Se pueden obtener de un donante, en el caso de las terapias alogénicas; o del mismo paciente, en el caso de las terapias autólogas. En este caso, se deben diferenciar dos tipologías de equipos; los primeros, que se basan en la recuperación de células en suspensión, y los segundos, que se basan en la recuperación de células a partir de tejidos. Un ejemplo de esta primera tipología de equipos sería Reveos® de Terumo, una plataforma capaz de realizar la separación de los diferentes componentes que conforman la sangre en un solo paso. Un ejemplo de equipo para la recuperación de células adherentes, como las del tejido adiposo sería Celution® 800 de Cytori.
El siguiente paso es la selección de las células de interés mediante el enriquecimiento del tipo celular deseado. La selección de las células se puede realizar con técnicas de separación magnética, basadas en el uso de partículas magnéticas y un campo magnético para separar partículas de una suspensión. Algunos ejemplos de estos equipos son GibcoTM CTSTM DynaCellectTM de Thermo Fisher, CliniMACS® Plus System de Milteny Biotec, RoboSepTM-S de Stemcell Technologies y FerroSelectTM Array de Biomagnetics Solutions. También se pude realizar esta selección utilizando sistemas como Sefia Select y Sepax Pro de Cytiva que permiten hacer la separación utilizando tanto partículas magnéticas como la fuerza centrífuga.
Seguidamente, si así lo requiere el proceso, se procede a la introducción de material genético dentro de las células. Este proceso se puede realizar mediante transfección, utilizando virus, o permeabilizando la membrana celular para permitir la entrada de los genes de interés mediante técnicas de electroporación. En este segundo caso, se utilizan equipos como Nucleofector® de Lonza, CliniMACS® Electroporator de Milteny Biotec, ExPERT GTxTM de MaxCyte y NeonTM NxT de Thermo Fisher. En el caso de la transfección utilizando virus, este paso se suele realizar en paralelo con la expansión celular.
A continuación, se procede a la expansión celular, con el objetivo de obtener el número de células necesario para conseguir el efecto terapéutico deseado. La forma clásica de expandir las terapias basadas en células adherentes es utilizando sistemas de cultivo multicámara, como son CellStack® de Corning® y los Cell Factory Systems de Thermo Fisher, mientras que los sistemas de células en suspensión se basan en técnicas de membrana semipermeable, como sería G-rex® de Wilsonwolf.
Por otra parte, los sistemas de expansión celular automatizados y cerrados son capaces de reducir los problemas de contaminación por manipulación humana. Para esta tarea existen equipos, como por ejemplo Quantum Flex de Terumo, que es capaz de cultivar células adherentes y en suspensión, y los sistemas de biorreactores de olas, como son Wave Bioreactor (XuriTM) de Cytiva y Biostat® RM de Sartorius, para cultivar sistemas en suspensión. Finalmente, se encuentran los sistemas de nueva generación, como el AdvaX3 y el Facer, que están revolucionando este campo mediante el uso de sensores avanzados que monitorizan continuamente metabolitos clave, como glucosa y lactato, durante todo el proceso de cultivo. El sistema AdvaX3, por ejemplo, utiliza sensores para controlar el medio dentro del reservorio de acondicionamiento y realiza intercambios de medio automáticamente cuando los niveles de metabolitos están fuera de rango, asegurando así un entorno adecuado para el crecimiento celular. Por otro lado, el Facer de Aglaris ofrece una solución integral con un cartucho fungible de un solo uso que integra todos los sensores necesarios para la monitorización en tiempo real de parámetros críticos como el pH, la concentración de oxígeno disuelto, glucosa, lactato y temperatura. Esta capacidad de monitorización continua no solo permite un control preciso del entorno de cultivo, sino que también facilita la automatización de la perfusión de medio fresco según las necesidades específicas del cultivo celular, optimizando así la eficiencia y consistencia del proceso. Además, la precisión y la capacidad de respuesta del Facer le otorgan una ventaja adicional en la gestión de cultivos celulares comparado con otros sistemas disponibles.
Una vez finalizado el proceso de expansión, se procede a recuperar las células, formularlas y dosificarlas, previamente a la administración al paciente. Adicionalmente, puede ser necesaria la congelación de estas terapias para su conservación hasta el día de administración. Para la recuperación de las células, mediante tecnologías de fuerza centrífuga, se utilizan sistemas como CTS Rotea Counterflow de Thermo Fisher, KorusTM de Invetech y Ksep® de Sartorius. FINIA® de Terumo y Signata CT-5TM de Sexton son una representación de los equipos usados para la dosificación final del producto. Finalmente, en el caso que se congelen las células previamente a su aplicación, será necesario el uso de equipos específicos que permitan tanto una congelación como descongelación controlada para mantener una alta viabilidad celular. Para este paso, se utilizan equipos como Via ThawnTM y Via FreezeTM de Cytiva, ThawSTAR® de Biolife SolutionsTM y IceCube de Sy-lab.
Como se ha mencionado anteriormente, ninguno de estos equipos está completamente automatizado para respaldar la producción de terapias celulares de inicio a fin, ya que solamente realizan una operación unitaria. Los equipos de nueva generación son plataformas capaces de realizar gran parte de la secuencia productiva, de forma completamente automatizada, usando un único equipo o mediante la interconexión de varios sistemas (conexión cerrada). De esta manera, suministrando la muestra de células a tratar, se podría llegar a obtener el producto purificado para ser administrado sin la necesidad de intervención manual.
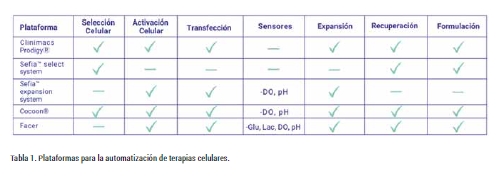
A continuación, en la Tabla 1, se describen algunos de los equipos capaces de automatizar varias de las etapas mencionadas y cuales son capaces de realizar:
Es importante destacar que las plataformas Clinimacs Prodigy® de Milteny Biotec y SefiaTM expansión system de Cytiva sólo son capaces de expandir cultivos en suspensión y en adherencia, respectivamente. Las plataformas Cocoon® de Lonza y Facer de Aglaris Cell pueden cultivar los dos tipos de cultivos celulares.
Finalmente, como una reciente tecnología revolucionaria en el desarrollo de terapias celulares, aparece Cellares, una plataforma capaz de producir simultáneamente hasta 16 terapias. Esta tecnología incorpora todas las etapas productivas; selección, activación, transducción, transfección, expansión, recuperación y formulación, además de ser capaz de colectar y analizar las muestras de control de calidad, generando de forma automática un batch report.
Otro de los retos a los que se enfrenta la fabricación de terapias celulares es como controlar, automatizar y digitalizar el proceso. El diseño del sistema de control tiene que estar focalizado en la interconectividad entre equipos de distintos fabricantes, garantizar la trazabilidad del lote durante todo el proceso, la flexibilidad y escalabilidad.
Para poder cumplir todos estos requerimientos a parte de los estrictamente normativos relacionados con la GMP, la estrategia de control tiene que basarse en una automatización modular con un nivel de granularidad hasta el MTP (Module Type Package). El MTP es una interface de automatización independiente del fabricante basado en NAMUR NE 148 que favorece el método ‘plug & play’, dónde el objetivo final es tener unidades más pequeñas, reutilización y puesta en servicio rápida. La producción modular usa bloques que se pueden unir, separar y reutilizar de diferentes formas para obtener distintos procesos.

En el archivo MTP se describe la funcionalidad de los módulos de procesos y hace que resulte más sencilla su conexión a las plataformas de automatización superiores de toda la instalación, como los sistemas de control de procesos. Trabajando a nivel de MTP se acorta el trabajo de ingeniería y reduce así también los costes de inversión para toda la instalación.
Conclusión
En conclusión, las terapias avanzadas ofrecen nuevas esperanzas para el tratamiento de enfermedades, pero su producción todavía enfrenta desafíos significativos, incluyendo la reducción de etapas manuales, el cumplimiento de los exigentes requisitos de calidad, y la gestión de procesos de fabricación costosos. A pesar de estos desafíos, la industria está respondiendo con innovaciones en la automatización y tecnología de los equipos, lo que permite una mayor eficiencia y consistencia en la producción de estas terapias. Estos avances, junto con un enfoque en la interconectividad, la trazabilidad, la flexibilidad y la escalabilidad, están ayudando a superar los obstáculos y a acelerar el desarrollo. A medida que continuamos avanzando en este campo, es esencial que sigamos explorando y adoptando nuevas tecnologías y enfoques para maximizar el potencial de las terapias avanzadas y llevar estos tratamientos revolucionarios a los pacientes que los necesitan.
En Klinea, contamos con un equipo de expertos para asesorarte en la elección de los mejores equipos adaptados a tu proceso y en la integración de sistemas para conseguir el nivel de automatización óptimo. Si estás interesado/a en conocer más sobre terapias avanzadas y cómo podemos ayudarte, contáctanos: klinea@klinea.eu
Referencias
[1] Lee, B. (2024). 2023 ASHG presidential address—Reflecting on our 75 years: Acknowledging our past, embracing our present, and dreaming about our future. American Journal Of Human Genetics, 111(3), 407-409. https://doi.org/10.1016/j.ajhg.2023.12.020
[2] Staff, G. (2023, 27 diciembre). Cell and Gene Therapy Manufacturing Costs Limiting Access. GEN - Genetic Engineering And Biotechnology News. https://www.genengnews.com/insights/cell-and-gene-therapy-manufacturing-costs-limiting-access/

| Nombre | Andrea Jordà, Jordi Gibert, Nuria Marí, Miquel Costa |
|---|---|
| Empresa | Klinea Biopharmaceutical Engineering y Aglaris Cell |
| Cargo | Ingeniera de proyectos, Responsable de la Unidad de Biotecnología, Directora Científica, Cofundador - Respectivamente |
Si continúas navegando, aceptas su uso.
Más información
Política de privacidad | Cookies | Aviso legal | Información adicional| miembros de CEDRO










































