Conocer los tiempos teóricos y reales de evaluación y aprobación de ensayos clínicos en CTIS es clave para establecer una adecuada estrategia de presentación a través de esta nueva plataforma europea. Basándonos en datos reales, anonimizados, hemos podido extraer valiosa información sobre el tiempo que transcurre entre que se presenta un nuevo ensayo o un ensayo en transición y el momento de su aprobación.
Certidumbre suele ser una palabra ajena a los que nos dedicamos al sector de la investigación clínica, por todo aquello que implica el método científico, ya que no siempre los resultados de una investigación clínica arrojan consecuencias positivas para su promotor. Pero alcanzar una cuota de certidumbre sí es posible si acotamos el campo de acción a la gestión de la documentación y el cumplimiento regulatorio, un escenario muchas veces incierto, pero a través del que podemos, con el conocimiento adecuado, reducir los tiempos necesarios para conseguir la evaluación y aprobación de nuestros ensayos clínicos.
Precisamente este es uno de los objetivos del CTIS (Clinical Trial Information System), la nueva plataforma de gestión de ensayos clínicos europea. Los que, como en mi equipo, llevamos años vinculados a su desarrollo (y – dicho sea de paso – somos responsables del 8% de las presentaciones de todos los ensayos comerciales realizadas en Europa por CTIS hasta la fecha), sabemos que esta nueva plataforma no es, todavía, perfecta, pero desde luego estamos convencidos de que ha llegado para mejorar, y mucho, la competitividad europea en lo que se refiere a la evaluación de los ensayos por parte de las agencias reguladoras.
Gestionar ensayos clínicos en la nueva plataforma europea de ensayos clínicos, CTIS, implica tener en cuenta no sólo los tiempos teóricos previstos en la EU CTR 536/2014, sino los tiempos reales que están tardando los Estados Miembros en evaluar y aprobar (en su caso), los ensayos clínicos presentados por esta vía.
En este artículo nos basamos en datos reales de nuestra propia experiencia que ayudan a comprender el nuevo escenario. Estos datos – anonimizados – corresponden al 8% de todos los ensayos clínicos comerciales presentados por CTIS desde que se puso en marcha (el 31 de enero de 2021) hasta noviembre de 2023, que son los que hemos gestionado desde Sermes CRO. Estas cifras implican más de 3.700 centros participantes y suman, en términos totales, 727 países implicados.
Tiempos de evaluación y aprobación previstos en la EU CTR 536/2014
La evaluación de una solicitud inicial de ensayo clínico está dividida en tres fases: la validación, la propia evaluación y la decisión. Los Estados Miembros Implicados (MSC: Member State Concerned) tienen, teóricamente, hasta 60 días para emitir la decisión de una solicitud de aprobación inicial, siempre que no haya RFIs (request for information).
Como se puede ver en la imagen, la validación conlleva 10 días. Este periodo puede aumentar otros 15 días adicionales si hay RFI: 10 días destinados a que el promotor responda a las consideraciones y otros 5 días más para que el Estado Miembro lo evalúe. En el caso de los ensayos clínicos multipaís, será necesario escoger un Estado Miembro Notificante (RMS: Reporting Member State) que lidere el proceso de evaluación de la Parte I. El país que actuará como RSM será confirmado por los Estados Miembros en esta fase de validación del estudio.
Las evaluaciones de la Parte I y de la Parte II se realizan en paralelo y tienen una duración máxima de 45 días, pero se pueden prolongar 31 días adicionales si hay RFI.
Aquí tenemos dos posibles estrategias: o bien presentar las partes I y II de manera simultánea, o bien hacerlo de manera consecutiva. Si se realiza la solicitud para las partes I y II para un país de forma simultánea, se evaluarán ambas partes de forma paralela y al final se obtendrá la decisión para ambas partes, por lo que nada más obtener la autorización se podrá iniciar el estudio en el país, siempre que se haya cumplido con los requisitos locales de estos mismos (Por ejemplo, en España, disponer del contrato firmado con el centro participante).
Sin embargo, si se realiza una solicitud en la que se presenta la parte I y para algunos países se presenta la parte II y para otros no, solo en los Estados miembros en los que el promotor presentó la solicitud completa (Parte I y Parte II) se evaluará todo el expediente, y una vez emitidas las decisiones positivas de estos Estados Miembros Implicados podría iniciarse un ensayo clínico en dichos países. Los demás Estados Miembros que para los que no se presentó la Parte II, solo evaluarán la Parte I junto con el resto de los países participantes, y solo recibirán la conclusión sobre la Parte I.
Esta conclusión es válida durante 2 años, dentro de los cuales se deberá de presentar la Parte II de esos países que no la habían presentado. Sólo cuando el Estado Miembro haya emitido una decisión positiva sobre la solicitud completa (Parte I y Parte II), el promotor podrá iniciar los ensayos en estos países. Si en el plazo de 2 años el promotor no presenta la Parte II en estos Estados Miembros, la conclusión de la Parte I caducará para esos países.
En la evaluación de la Parte I se examina la documentación científica asociada al estudio, como, por ejemplo, el protocolo y el producto en investigación (IMPD). Esta parte es evaluada por todos los países implicados, pero está coordinada por uno de ellos, el RMS.
En cambio, la evaluación de la Parte II se realiza por cada Estado Miembro Implicado y se valoran aspectos de naturaleza local/nacional relacionados con el paciente, como por ejemplo la hoja de información al paciente y consentimiento informado y/o los materiales de reclutamiento del ensayo.
Una vez evaluada la Parte I y la Parte II, los países tienen 5 días para emitir la decisión del estudio, es decir: si se autoriza, se autoriza con condiciones o no se autoriza.
En conclusión, si sumamos todos los tiempos (validación, evaluación y decisión), obtenemos como resultado que recibiremos una respuesta de CTIS en 106 días. Sin embargo, hay una serie de cuestiones que pueden hacer que este número de días se prolongue. Veamos cuáles son y cómo están influyendo en los datos de tiempos reales.
Parada de reloj
Un detalle a tener muy en cuenta a la hora de analizar cuál es la mejor fecha para presentar un ensayo clínico por CTIS es la llamada parada de reloj. Estos son los casos en los que no aplican los tiempos establecidos porque a ellos hay que sumar los días de parada de reloj:
Parada de reloj en Navidad (Winter clock stop): esta parada de reloj implica 16 días en los que se paran todos los tiempos de validación, evaluación y decisión. Por ello, dependiendo de tus objetivos, quizás es una buena idea evitar presentar ensayos clínicos en diciembre para no tener esta demora. Esta parada de reloj se producirá el 22 de diciembre a las 23:59:59 y se reanudará el 8 de enero del año siguiente a las 00:00:01
Fiestas nacionales (Bank holidays): cada Estado Miembro Interesado tiene diferentes calendarios de días no laborables. Por ejemplo, en los casos de ensayos clínicos multipaís, el proceso de selección del Estado Miembro Notificante se regirá por el calendario más largo de los Estados Miembros Implicados.
La fecha de vencimiento de una tarea que aplica a los Estados Miembros (due date): la fecha de vencimiento tiene que caer en un día laborable.
Nuevos ensayos clínicos vía CTIS: ejemplos de tiempos reales
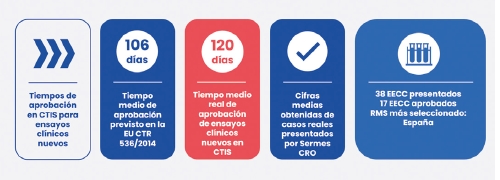
De los 38 nuevos ensayos clínicos que hemos presentado por CTIS, hasta la fecha hemos recibido la aprobación de 17. Hemos calculado la media de días en la que hemos recibido esta aprobación y el resultado es de 120 días, es decir, 14 días más del tiempo teórico que establece la regulación, que, como hemos comentado, son 106 días. La causa, en este caso, ha sido la parada de reloj en Navidad y los días de fiesta de los Estados Miembros Implicados.
El Estado Miembro Notificante más elegido para estas evaluaciones ha sido España, lo cual nos complace enormemente.
Transición de ensayos clínicos a CTIS: ejemplos de tiempos reales
De la misma manera que las nuevas solicitudes de ensayos clínicos por CTIS pueden tardar hasta 106 días, las transiciones de ensayos clínicos a CTIS pueden tardar hasta 82 días en ser aprobadas.
De los 82 ensayos clínicos cuya transición hemos solicitado por CTIS, hasta la fecha hemos recibido la aprobación de 72. En base a nuestra experiencia, hemos calculado la media de días en la que hemos recibido esta aprobación y el resultado es de 74 días, es decir, 8 días menos del tiempo teórico que establece la regulación, que, como hemos comentado, son 82 días.
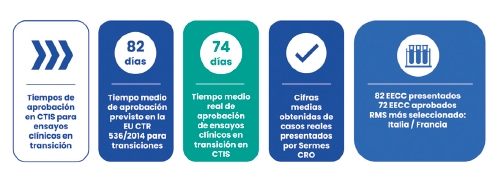
En nuestro anterior análisis, con los casos realizados hasta agosto de 2023, las aprobación de las transiciones ocurría de media en el día 88, lo que quiere decir que se ha producido una mejora por parte de las agencias reguladoras de los países a la hora de evaluar los ensayos en transición, que ahora tardan 72 días de media. Los Estados Miembros Notificantes más elegidos para estas evaluaciones han sido Italia y Francia.
En definitiva, el análisis comparativo entre los tiempos teóricos y reales de evaluación y aprobación de ensayos clínicos en el CTIS aporta una visión del proceso basada en casos reales que puede ser muy práctica para los gestores de nuestro sector. Aunque los plazos establecidos por la normativa sugieren una respuesta en 106 días para los nuevos estudios, la realidad es que hay una serie de factores que pueden influir en la prolongación de este período. La consideración de aspectos como la parada de reloj durante las festividades o los días no laborables en los Estados Miembros suman más complejidad al proceso. Sin embargo, a pesar de estos desafíos, los datos muestran una mejora gradual en los tiempos de aprobación, al menos en las transiciones a CTIS, lo que refleja un progreso en la eficiencia de las agencias reguladoras. Estos hallazgos respaldan la importancia de comprender tanto los tiempos teóricos como los reales para una gestión efectiva de los ensayos clínicos en la plataforma europea CTIS, contribuyendo así a una mayor certidumbre en un ámbito donde la incertidumbre suele ser la norma.
Descarga sugerida:
Artículo escrito por:
Lidya Domínguez
Directora de investigación clínica
Sermes CRO




