Tipos de isotermas y mecanismos de adsorción de disolventes en excipientes farmacéuticos
Introducción
Las isotermas de sorción describen la cantidad de vapor adsorbido o desorbido a diferentes concentraciones de equilibrio (presiones parciales) en la fase gaseosa. La forma de una isoterma de sorción depende de la interacción entre las moléculas de vapor y la muestra sólida y permite sacar conclusiones sobre el mecanismo de sorción. Por este motivo, no es sorprendente que vapores de distinta naturaleza puedan mostrar distintas formas de isoterma al adsorberse en el mismo material. Esto tiene implicaciones en todos los procesos en los que intervienen disolventes, como la granulación húmeda, la cristalización o el secado.
En el presente artículo se demostrarán las diferencias en el comportamiento de adsorción entre disolventes mediante la adsorción de agua y una serie de alcoholes en una muestra cristalina de α-lactosa monohidrato. Las isotermas de adsorción resultantes se ajustarán a diferentes modelos de adsorción y se extraerán conclusiones sobre el mecanismo de adsorción.
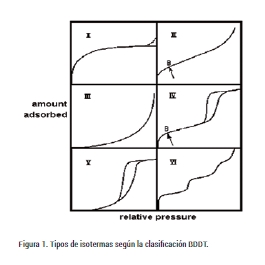
Las formas de las isotermas se describen generalmente mediante la clasificación BDDT [2]. Este sistema distingue cinco tipos diferentes de isotermas de sorción (tipo I – V), que luego se amplió con un tipo VI adicional. Se muestran en la Figura 1.
Sin embargo, las isotermas de tipo VI no tienen relevancia para la sorción de vapor en condiciones ambientales y las isotermas de tipo I rara vez se observan a menos que el material sea fuertemente microporoso o se produzca quimisorción. Se pueden identificar claramente dos conjuntos de isotermas. Un conjunto, que consta de los tipos II y IV, muestra una absorción significativa a bajas presiones parciales seguida de una pequeña adsorción a una concentración de vapor intermedia y nuevamente una absorción alta a presiones parciales elevadas. El otro conjunto comprende las isotermas de tipo III y V con una absorción baja característica a baja concentración y un fuerte aumento de la adsorción a una concentración de vapor más alta.
Estas diferencias en el comportamiento de adsorción y desorción se deben a diferencias en la entalpía de sorción de los solventes [3]. Esto se ilustra en la Figura 2.

El caso opuesto es cuando el vapor tiene una interacción con la superficie que es energéticamente similar o apenas superior a la interacción con otra molécula de vapor (lo que significa que el calor de sorción es similar al calor de condensación). Esto hace que sólo unas pocas moléculas se adsorban a baja concentración (prefieren interactuar libremente en la fase de vapor), seguida de una condensación a presiones parciales más altas en las pocas moléculas adsorbidas inicialmente.
En realidad, estos dos mecanismos y las formas de isoterma correspondientes son extremos y suelen darse en combinación debido a la naturaleza heterogénea de las superficies reales. Sin embargo, es extremadamente útil comprender los mecanismos fundamentales que impulsan la adsorción en superficies sólidas.
Todos los experimentos se realizaron en un analizador de sorción de vapor gravimétrico automatizado DVS. El DVS mide la absorción y la pérdida de vapor gravimétricamente utilizando una ultrabalanza con una resolución de masa de ±0,1 μg. La concentración relativa alrededor de la muestra se controló mezclando corrientes de gas portador saturado y seco utilizando controladores de flujo másico. La temperatura de medición se mantuvo constante a 25,0° C (±0,1° C), encerrando todo el sistema en una incubadora con temperatura controlada.
Se cargó una masa de 20 mg para los experimentos con agua (y alrededor de 100 mg para las mediciones de alcohol) en un recipiente de muestra y se colocó en el sistema. Antes de exponerlas a cualquier vapor, las muestras se equilibraron durante un breve período a 0 % p/po para eliminar cualquier agua superficial presente y establecer una masa de referencia seca. A continuación, las muestras se expusieron al siguiente perfil de concentración: 0 a 10% en pasos de 1%, 20% a 90% en pasos de 10%, 95% y lo mismo para la desorción. En cada etapa, se dejó que la masa de la muestra alcanzara el equilibrio antes de aumentar o disminuir la presión parcial. A partir del perfil completo de sorción y desorción, se calculó una isoterma utilizando DVS Advanced Analysis Suite v3.6.
La muestra de α-lactosa monohidrato se obtuvo de Acros y se recristalizó exponiéndola a una atmósfera de alta humedad. Este procedimiento se aplicó para garantizar que se eliminara cualquier contribución de la fase amorfa. Los alcoholes utilizados en este estudio fueron metanol, etanol, 1-propanol y 1-butanol, todos suministrados por Aldrich. El agua desionizada fue suministrada por Fisher.
Resultados
La Figura 3 muestra las isotermas de adsorción y desorción para dos ciclos de agua a 25 °C. Existe una buena concordancia entre la rama de adsorción y la desorción, lo que sugiere que no hay histéresis significativa. El segundo ciclo es casi idéntico al primero, lo que confirma que no hay efectos irreversibles involucrados.

La Figura 4 muestra una comparación de las isotermas del alcohol. Solo se muestran las isotermas de adsorción del primer ciclo, ya que no hubo histéresis ni diferencias significativas entre el primer y el segundo ciclo. También se incluyó la isoterma de adsorción de agua del primer ciclo para la comparación con los mismos niveles de absorción.

El agua suele mostrar un comportamiento de tipo III cuando se adsorbe en superficies de baja energía debido a su fuerte enlace de hidrógeno intermolecular. Por esta razón, no se recomienda utilizar agua como molécula de prueba en una determinación de superficie BET. Los alcoholes muestran un tipo de isoterma mixta debido a su contribución polar (del grupo OH) y su cadena de alcanos no polar. Cuanto mayor sea la longitud de la cadena, menos polar será el alcohol. Es por esta razón que el butanol se acerca a una isoterma de adsorción de tipo II típica.
Para respaldar las conclusiones extraídas anteriormente, las isotermas se han ajustado a una variedad de modelos de sorción de vapor utilizando SMS Isotherm Suite v1.1.
Entre los diversos modelos aplicados, los resultados de la ecuación de Kuhn deben examinarse más de cerca para esta aplicación. La ecuación de Kuhn se basa en el supuesto de un potencial de adsorción diferente para cada sitio de la superficie, combinado con la formación de grupos en cada sitio a medida que aumenta la presión parcial [4]. Este mecanismo corresponde al comportamiento de tipo III. Por esta razón, no es sorprendente que la ecuación resulte ser la que mejor se ajusta a la isoterma de sorción de agua, pero que se ajuste mal a las isotermas de alcohol. Esto refleja el cambio significativo de un comportamiento de tipo III fuerte a un comportamiento de tipo II/III mixto para los alcoholes. Estos hallazgos se ilustran en la Figura 5 para el agua (izquierda) y el 1-butanol (derecha).
Conclusión
Este método proporciona una validación confiable, precisa e independiente de la generación y medición de HR en la instrumentación de sorción de agua DVS.
- [1]Frank T.., Daniel B., Surface Measurement Systems Ltd.. DVS Application Note 26
- [2]Brunauer, S, Deming, L., Deming, W. and Teller, E., J. Amer. Chem. Soc. 62 (1940), 1732
- [3]Gregg, S. and Sing, K., Adsorption, Surface Area and Porosity, 2nd edition, Academic Press, NY 1982
- [4]Kuhn, I., J. Coll. Interf. Sci. 23 (1967), 563

| Nombre | Iñigo Zabalía García |
|---|---|
| Empresa | IESMAT |
| Cargo | Director del área de producto en IESMAT. Miembro de la dirección |
Si continúas navegando, aceptas su uso.
Más información
Política de privacidad | Cookies | Aviso legal | Información adicional| miembros de CEDRO









































